公募研究
 佐藤 卓史
佐藤 卓史
熊本大学発生医学研究所 分化制御分野
〒860-0811 熊本県熊本市中央区本荘2-2-1
TEL: 096-373-6607
FAX: 096-373-6609
E-mail: tsato@kumamoto-u.ac.jp
研究室ホームページ: http://www.imeg.kumamoto-u.ac.jp/divisions/cell fate control/index.html
<略歴>
2003年:熊本大学薬学部卒、2008年:熊本大学大学院薬学教育部博士後期課程修了(薬学博士)、2007-08年:日本学術振興会特別研究員(DC2)、2008-09年:日本学術振興会特別研究員(PD)、2009-11年:熊本大学グローバルCOEプログラム「細胞系譜制御研究の国際的人材育成ユニット」 Research Associate、2011-12年:福島県立医科大学 医学部附属生体情報伝達研究所 助教。2012年より:熊本大学発生医学研究所分化制御分野 研究員。
<研究課題>
A02 脂質メディエーターとHippoシグナル経路が織りなす細胞集団の秩序化機構の解明
<研究計画>
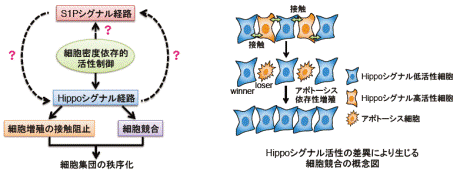
個々に動く細胞は「細胞増殖の接触阻止」による細胞集団の拘束や近年、注目を集めている「細胞競合」(細胞が互いの適応度を競合し、適応能力で勝る細胞 (winner) が劣る細胞 (loser) を積極的に排除する機構)による細胞集団の最適化を受け、秩序ある器官・形態形成を行うと考えられる。両機構とも細胞間接触依存的に起こる現象であり、その機構には癌抑制シグナル経路であるHippoシグナル経路の活性化が深く関わる。しかしながら、両機構において細胞間接触とHippo経路活性化を繋ぐ最上流の経路およびその分子機構に関しては不明な点が多い。本研究では、マイクロアレイ解析により同定した細胞密度依存的に活性化する可能性を有するS1Pシグナル経路とHippo経路とのクロストークを明らかにし、脂質メディエーターS1Pによる細胞集団の秩序化機構に関わる分子の同定を目指す。
<イメージ図>
<代表的論文>
1. *Sato T, Sako Y, Sho M, et al. STT3B-dependent posttranslational N-glycosylation as a surveillance system for secretory protein. Mol. Cell Jul 13;47(1):99-110 (2012) (*Corresponding author)
2. Miyata M, Sato T, (equal contribution) et al. The crystal structure of the green tea polyphenol (-)-epigallocatechin gallate-transthyretin complex reveals a novel binding site distinct from the thyroxine binding site. Biochemistry Jul 27;49(29):6104-14 (2010)
3. Susuki S, Sato T, (equal contribution) et al. The Endoplasmic reticulum-associated degradation of transthyretin variants is negatively regulated by BiP in mammalian cells. J. Biol. Chem. Mar 27;284(13):8312-21 (2009)
4. Sato T, Susuki S, et al. Endoplasmic reticulum quality control regulates the fate of transthyretin variants in the cell. EMBO J. May 16;26(10):2501-12 (2007)
