公募研究
 栗山 正
栗山 正
秋田大学大学院医学系研究科腫瘍制御医学系
分子生化学講座
〒010-8543 秋田県秋田市本道1−1−1
TEL: 018-884-6078
FAX: 018-884-6078
E-mail: seikury@med.akita-u.ac.jp
研究室ホームページ:http://www.med.akita-u.ac.jp/~seika2/Akita_Univ._Dept._Molecular_Biochemistry/Welcome.html
<略歴>
1996年:関西学院大学理学部卒、1998年:同大博士前期課程修了、2002年:関西学院大学理学博士号取得。2001-2005年:熊本大学大学院医学薬学研究部神経分化学講座において21世紀COEリサーチアソシエイト(太田訓正 現准教授)、2005年:同大神経分化学講座 助手、2005-2009年:英国、University
College London (Roberto Mayor lab) ポスドク、2009年 秋田大学大学院医学系研究科腫瘍制御医学系分子生化学講座(田中 正光教授)の准教授として採用。現職。
<研究課題>
A01 細胞接触センサーから直接伝わる細胞骨格編集シグナルの研究
<研究計画>
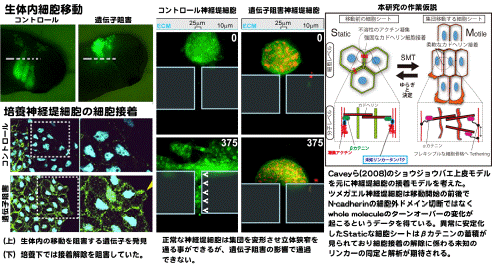
ツメガエル神経堤細胞は生体内において集団で移動する。これまでに集団移動を可能にするメカニズムをいくつか報告した12 3。一方、培養されたツメガエル神経堤細胞はEpithelial-to-mesenchymal
transition (EMT)を起こす。ある遺伝子の阻害からin vitroでのEMTとin vivoでの集団移動のギャップに相当する表現形を見出した:細胞はin vitroにおいて細胞接着を解除できず、In vivoでは移動できない。誘引シグナルによって集団移動を引き起こし、その移動経路に立体狭窄部を作ると細胞集団は変形できずに狭窄に詰まってしまった。細胞外の接着分子は接着状態を保っていても細胞同士が位置関係を変えられるように細胞骨格と接着装置の関係を変化させている可能性がある。Static(静的)とMotile(動的)な2つの接着モードがあることを証明し、その変化のメカニズムを追う。
<イメージ図>
<代表的論文>
1. Tanaka M, Kuriyama S, Aiba N Nm23-H1 regulates contact inhibition of locomotion, which is affected by ephrin-B1. J Cell Sci 125: 4343-53 (2012) doi: 10.1242/jcs.104083
2. Theveneau E, Marchant L, Kuriyama S, Gull M, Moepps B, Parsons M, Mayor R Collective chemotaxis requires contact-dependent cell polarity. Dev Cell 19: 39-53 doi: 10.1016/j.devcel.2010.06.012.
3. Carmona-Fontaine C, Matthews HK, Kuriyama S, Moreno M, Dunn GA, Parsons M, Stern CD, Mayor R Contact inhibition of locomotion in vivo controls neural crest directional migration. Nature 456: 957-61 doi: 10.1038/nature07441.
