研究内容Research
SUMO翻訳後修飾
真核生物がタンパク質の機能に多様性を持たせるために確立した翻訳後修飾に関する研究が進められ、細胞の制御に重要な役割を果たしていることがわかってきました。その中でユビキチンに類似した新規修飾分子として、 SUMOのバラエティーに富んだ働きが現在注目を集めています。
1. タンパク質の翻訳後修飾
タンパク質は、リン酸化や糖鎖付加、メチル化、アセチル化などによる活性調節、あるいは安定性の制御に関わる修飾を受けています。この様なタンパク質の翻訳後修飾は、タンパク質の局在、機能調節において非常に重要な役割を担っています。高等生物では、遺伝子配列に基づき合成されたタンパク質が、直接機能を発揮することは稀で、前述したような種々の翻訳後修飾を受けることで初めてその機能を発揮します。さらに、2004年ノーベル化学賞の受賞対象となったユビキチン分子に代表されるポリペプチドの付加による翻訳後修飾というものもあります。ユビキチンによる修飾は、プロテオソームを介したタンパク質分解のシグナルとなり、細胞内のタンパク質の存在調節に重要な働きをしているのです。
近年、ゲノム情報解読の進展により、ユビキチンと類似したタンパク質の存在が次々と明らかになってきました。SUMOはその代表的な修飾分子であり、その名前の由来からもわかるように、非常にユビキチンに類似した構造をしています。しかし、その機能はユビキチンとは全く異なり、修飾されたタンパク質は分解には至らず、タンパク質間の相互作用・活性・局在などにおいて変化を受けます。また、ユビキチン化と拮抗して、SUMO化はタンパク質の安定化に寄与する場合もあります。こういった機能が細胞周期、染色体組換え・分配、クロマチン動態などに関わり、発生や増殖の制御を行っているということが明らかになってきました。私たちの研究室ではこのSUMOについて、シロイヌナズナと分裂酵母をモデルとして真核生物におけるSUMOの役割を解明する研究を行っています。
SUMOがユビキチンと類似しているのはその構造だけでなく、標的タンパク質に結合する様式も非常によく似ています。 SUMOは C末端が数アミノ酸分伸長した前駆体として合成され、プロテアーゼの作用によりC末端の伸長部分をGly-Glyが露出するように切断され、成熟型となります。成熟型となったSUMOは、E1活性化酵素によってC末端のCOOH基がアデニル化されE1との間にチオエステル結合を生じます。 E1はユビキチン活性化酵素E1のN末端側に相同性のあるAos1とC末端側に相同性のある Uba2から成るヘテロダイマーとして機能する酵素です。次いでSUMOはE2結合酵素に運ばれ、E2ともチオエステル結合します。ユビキチン結合酵素が複数存在するのに対してSUMO結合酵素はUbc9一つだけです。ユビキチンはこの次のステップとしてE3リガーゼを介して、標的タンパク質の特異性を決定しています。しかし、 SUMO経路においてはE2がSUMOと標的タンパク質との結合を触媒し、標的タンパク質によってE3を必要とするものと必要としないものに分けられると考えられています。
SUMOはC末端のCOOH基と標的タンパク質のLys残基のε-アミノ基との間に共有結合を生じる事でタンパク質を修飾します。さらに、 SUMO化はシステインプロテアーゼにより標的タンパク質から切り離される脱SUMO化という作用を受ける、可逆的な経路です。以上がSUMO化経路の一連の流れです。
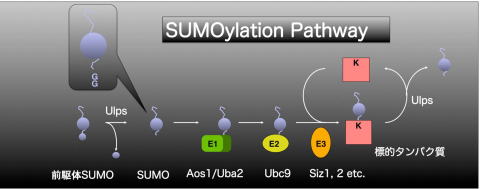
図1.SUMO化経路
2. 植物におけるSUMO
SUMOが重要な機能を担っているという事は、最近の研究からわかってきています。しかし、植物にとってSUMOがどのような働きをしているかは、まだまだわからない事がたくさんあります。そこで、私たちの研究室ではシロイヌナズナをモデル植物として、植物におけるSUMO化修飾機構の解析を行っています。
UMOタンパク質は酵母には1つ、ヒトでは4つ確認されており、シロイヌナズナには8つも存在すると考えられています。しかし、この中で ESTが確認されているものはSUMO-1,-2,-3,-5の4つのみで、残りのSUMOは偽遺伝子でなければその発現量は非常に少ないでしょう。現在までに植物においてSUMO経路が関わっている報告はいくつかありますが、その標的タンパク質はまだ発見されていません。私たちはシロイヌナズナSUMO経路において 1つしか存在しないE2結合酵素と相互作用するタンパク質を単離する事でSUMOの標的タンパク質を同定することができるのでは!?と考えました。
Yeast two-hybrid法を用いてE2に結合するタンパク質をスクリーニングした結果、私たちは3つのタンパク質の単離に成功しました。1つはSUMO経路のE3リガーゼであとの2つはどちらも機能未知のタンパク質でした。更に詳しく解析し、どちらのタンパク質もSUMOとも相互作用する事を確認しました。現在、実際に植物体でこれらのタンパク質がSUMO化されるかを調べています。今後、植物におけるこの2つの遺伝子の機能及び、SUMO化の意義を解明することを目的として、実験を進めています。
3. 分裂酵母におけるSUMO
先程説明したように、ヒトやシロイヌナズナでは複数のSUMOが確認されていますが、酵母においてSUMOは1つしか確認されていません。酵母は分裂方法により出芽酵母(Saccharomyces cerevisiae)と分裂酵母(Shizosaccharomyces pombe)に分類されていて、それぞれSmt3とPmt3と呼ばれるSUMOが確認されています。出芽酵母SUMOのSmt3は酵母の生育に対して必須であるため、この遺伝子を欠損させると酵母は生育することができません。しかし、分裂酵母SUMOのPmt3は生育に必須ではなく、この遺伝子を欠損させても酵母は生育することができます。ただし、pmt3遺伝子を欠損させた酵母は生育遅延や様々な環境ストレスに対して感受性を示します。
わたしたちの研究室では、これまでSUMOの標的となるさまざまな候補タンパク質をプロテオミクス法により同定してきていて、これらのタンパク質のSUMO化部位の同定・機能解析を行い、酵母におけるSUMOシステムの意義を解明することを目的としています。


