|
2. 植物におけるSUMO
SUMOが重要な機能を担っているという事は、最近の研究からわかってきています。しかし、植物にとってSUMOがどのような働きをしているかは、まだまだわからない事がたくさんあります。そこで、私たちの研究室ではシロイヌナズナをモデル植物として、植物におけるSUMO化修飾機構の解析を行っています。
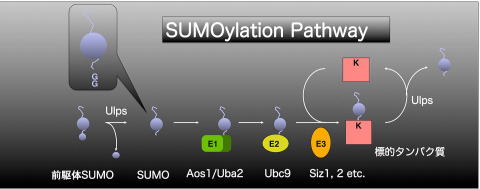
SUMOタンパク質は酵母には1つ、ヒトでは4つ確認されており、シロイヌナズナには8つも存在すると考えられています。しかし、この中で ESTが確認されているものはSUMO-1,-2,-3,-5の4つのみで、残りのSUMOは偽遺伝子でなければその発現量は非常に少ないでしょう。現在までに植物においてSUMO経路が関わっている報告はいくつかありますが、その標的タンパク質はまだ発見されていません。私たちはシロイヌナズナSUMO経路において 1つしか存在しないE2結合酵素と相互作用するタンパク質を単離する事でSUMOの標的タンパク質を同定することができるのでは!?と考えました。
Yeast
two-hybrid法を用いてE2に結合するタンパク質をスクリーニングした結果、私たちは3つのタンパク質の単離に成功しました。1つはSUMO経路のE3リガーゼであとの2つはどちらも機能未知のタンパク質でした。更に詳しく解析し、どちらのタンパク質もSUMOとも相互作用する事を確認しました。現在、実際に植物体でこれらのタンパク質がSUMO化されるかを調べています。今後、植物におけるこの2つの遺伝子の機能及び、SUMO化の意義を解明することを目的として、実験を進めています。
3. 分裂酵母におけるSUMO
先程説明したように、ヒトやシロイヌナズナでは複数のSUMOが確認されていますが、酵母においてSUMOは1つしか確認されていません。酵母は分裂方法により出芽酵母(Saccharomyces
cerevisiae)と分裂酵母(Shizosaccharomyces
pombe)に分類されていて、それぞれSmt3とPmt3と呼ばれるSUMOが確認されています。出芽酵母SUMOのSmt3は酵母の生育に対して必須であるため、この遺伝子を欠損させると酵母は生育することができません。しかし、分裂酵母SUMOのPmt3は生育に必須ではなく、この遺伝子を欠損させても酵母は生育することができます。ただし、pmt3遺伝子を欠損させた酵母は生育遅延や様々な環境ストレスに対して感受性を示します。
わたしたちの研究室では、これまでSUMOの標的となるさまざまな候補タンパク質をプロテオミクス法により同定してきていて、これらのタンパク質のSUMO化部位の同定・機能解析を行い、酵母におけるSUMOシステムの意義を解明することを目的としています。
|