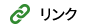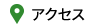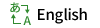研究内容
研究のコンセプト
有機合成化学は,医農薬・高分子・機能性分子などの有用有機化合物の生産等を通じ広く社会に貢献しており,現在社会において不可欠で価値のある学問としての地位を確保しています.その一方で,公害汚染,エネルギー問題など様々な課題も浮き彫りとなってきました.
このような現状を踏まえ,今後の有機化学の目指すべきもののひとつは,高選択的で,かつ,環境問題も考慮した,グリーンで工業的に可能な「total cost effective」な有機合成反応の創製であると考え,当研究室では,田辺教授の化学メーカーでの10年の企業経験,5大学研究室での経験を生かし, 以下の3つのテーマを軸として,関学のスクールモットー "Mastery for Service" にのっとり,「環境調和」「実用性」をキーワードに社会に役立つ有機合成反応の開発を行い,社会へのコミットを図っています.
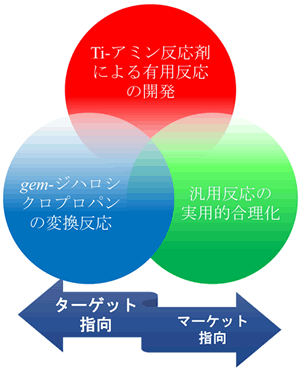
(1)独自のTi-amine反応剤による有用反応の開発
(2)3員環化合物を利用する独自のユニークな新有用反応の開発
(3)汎用反応の実用的合理化
それぞれの円をクリックすると,詳しい説明ウィンドウが出ます.
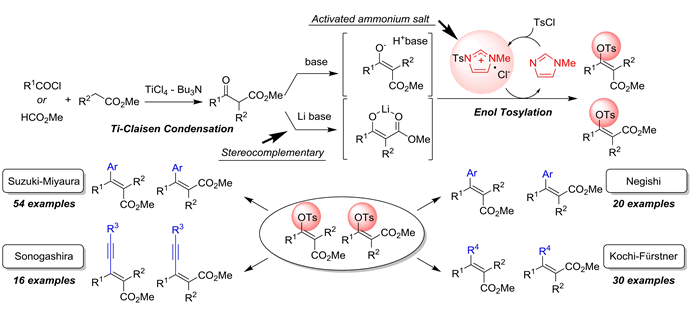
(1)Ti-Claisen縮合を機軸とする独自のTi(Zr)-amine反応剤による有用反応の開発
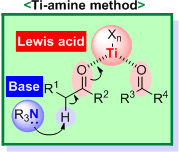
種々のカルボニル求核剤と求電子剤間で付加・縮合反応を行う合成手法 (aldol 反応,Mannich 反応,Claisen 縮合など) は,従来,LDA
などの強塩基反応剤が用いられてきましたが,反応性・選択性・基質適用範囲の面で限界がありました.これに対して,当研究室では,TiCl4 などの Lewis 酸と第3級アミンを組み合わせる「Ti-amine反応剤」を用いる独自の手法を開発しています.本方法は,従来法と比べて,温和で高い反応性・選択性を有しています.
Ref. Org. Biomol. Chem., 5, 151-159 (2007).
【主な例】
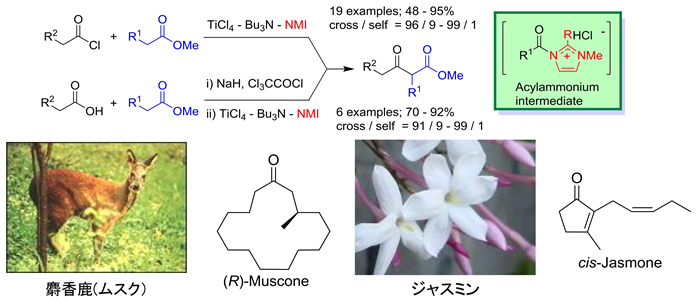
1.Ti-Claisen縮合 (J. Am. Chem. Soc. 2005, 127, 2854.)
Claisen縮合は,発明から100年以上経過していますが,類型のアルドール付加反応が,今日,爆発的に発展したのとは対照的に研究例は驚くほど少なく,イノヴェーションのある研究はほとんどありませんでした. これに対して,「Ti-amine反応剤」を用いて,当量同士のエステル(求核剤)および酸クロリドまたはカルボン酸(求電子剤)間の基質一般性の高い交差型 Claisen 縮合を開発しました.Bu3N は,エステルエノラートの発生に関与し,N-メチルイミダゾールが非常に有効なアシル活性化剤として働いています.この方法は,代表的天然香料である (R)-muscone, cis-jasmone の最短段階合成に応用しています.
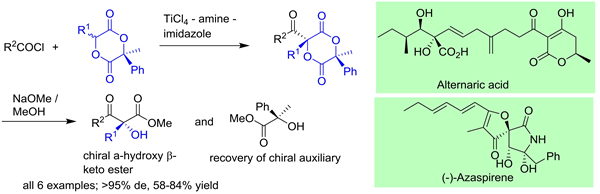
2.不斉交差型 Ti-Claisen 縮合への展開 (Chem. Comm. 2013, 49, 7001.)
Ti-Claisen縮合の展開として,求核剤基質として光学活性 1,4-ジオキサン-2,5-ジオン,求電子剤として酸クロリドを用いる不斉 Ti-Claisen 縮合を開発しました.非常に高いジアステレオ選択性(>95% ee)で目的の -ケトエステルを合成することに成功します.不斉補助基は入手容易であり,しかも反応後ラセミ化することなく,簡便な方法 (NaOMe / MeOH) でほぼ完全に回収可能できます.この反応を利用し,天然物である植物毒素 Alternaric acid の短段階形式不斉全合成を達成し,さらに,現在,血管新生抑制剤として注目されている (-)-Azaspirene の不斉全合成も行っています.
(2)3員環化合物を利用する独自のユニークな新有用反応の開発
シクロプロパンは,再小員炭化水素環として,様々な有機化学的特徴を有しています.当研究室は,gem-ジハロシクロプロパンに着目し,その特異性を十分に生かすことで (A) カチオン的 (B) ラジカル的 (C) アニオン的と,有機反応の多角的角度からアプローチ,全く新しいタイプの有用有機反応の開発を行っています.
(有機合成化学協会誌 1999, 57, 170.)
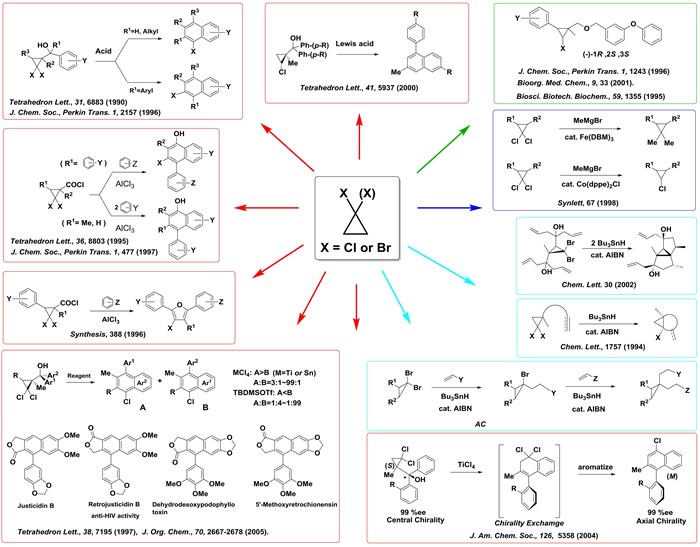
中でも,gem-ジハロシクロプロピルメタノール (AACM) にLewis 酸もしくはBrønsted 酸を作用させると,シクロプロパンの開裂反応を起点とするベンズアヌレーション反応が進行することを見出しています.本反応では,異なるアリール基を有する AACM の環化方向を用いる酸を選択することで制御することが出来ます.このベンズアヌレーション反応を鍵段階とするリグナンラクトン系天然物の全合成も達成しています.
(Tetrahedron Lett. 1997, 38, 7195; J. Org. Chem. 2005, 70, 2667.)
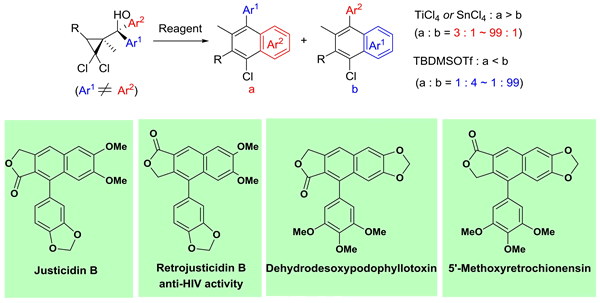
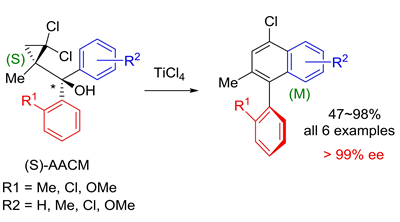
この更なる展開として,光学活性の AACM を用いる軸性不斉転写型ベンズアヌレーション反応の開発にも成功しています (J. Am. Chem. Soc. 2004, 126, 5358.).
(3)汎用反応の実用的合理化 (有機合成協会誌 2004, 62, 1249.)
本格的な少子高齢化時代を迎え,日本政府の医療費削減は一つの重要な行政課題であり,安価・安定な価格で有効な医薬品を患者に提供することが求められています.
そのような観点から,医農薬・香料などのファインケミカルズの製造において,プロセス化学が最近注目されています.私たちは,total cost-effective な「速かろう・安かろう・良かろう」を基本的なコンセプトとして,エステル化・スルホニル化・アミド化・シリル化などの教科書反応を対象とし,プロセス化学に役立つ経済的・環境調和型の有機合成をマーケットイン指向で開発しています.
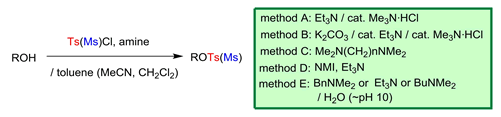
1.スルホニル化(ピリジン・フリー法)
① アルコールのスルホ二ル化 (Tetrahedron 1999, 55, 2183; Synthesis 1999, 1633. etc)
スルホニル化反応は有機合成上基本的かつ重要な反応であり,医薬品等のファインケミカルズの合成に頻繁に用いられています.トシル化は従来 TsCl – Pyridine 法が伝統的ですが,この方法は,(1) 反応性が不十分,(2) 環境に負荷の大きいピリジンを過剰量必要, (3) 一旦生成したトシラート(メシラート)がクロリドに転化し易いなどの問題を有していました.
当研究室では,Me3N などの立体的嵩高さの小さい第三級アミンが,スルホニル化反応に有効であることを見出しました.
② 多置換 α,β-不飽和エステルの立体補完的合成法 (Org. Lett. 2008, 10, 2131; Org. Lett. 2009, 11, 4258.)
多置換オレフィンの高立体選択的合成は有機合成上,基本的に重要です.中でも三または四置換オレフィンは,未だ重要な課題です.こういった背景のもと,当研究室では,β-オキソエステルの立体補完的エノールトシル化,さらに得られたエノールトシラートの立体保持クロスカップリングを用いる三置換および四置換 α,β-不飽和エステルの立体補完的合成法を見出しました.すなわち,TsClと N-メチルイミダゾール (NMI) から形成される高活性スルホニウムアンモニウム塩中間体を鍵とし,TsCl-NMI-Et3Nを用いると熱力学的に安定な E-エノラートが生じ,高 E 選択的に (Method A),TsCl-NMI-LiOH を用いると金属が β-ケトエステルにキレーションし Z-エノラートが生じ高 Z 選択的に (Method B) 反応が進行します.得られたエノールトシラートは,各種クロスカップリングに適用可能で,完全に立体保持したまま進行します.
2.エステル化・アミド化・チオエステル化
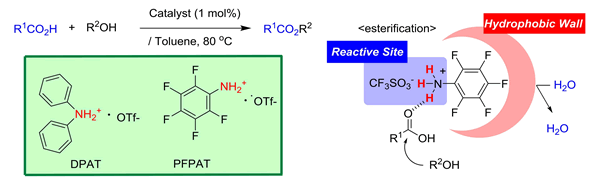
① アンモニウムトリフラート触媒(DPAT, PFPAT)を用いる触媒的エステル化・チオエステル化・マクロラクトン化反応 (Green Chem. 2006, 8, 1022.)
酸触媒を用いるエステル化反応は,副生成物が H2O のみであり,グリーンケミストリーの観点から魅力的です.当研究室では,ジフェニルアンモニウムトリフラート(DPAT)や 2,3,4,5,6-ペンタフルオロフェニルトリフラート(PFPAT)がエステル化反応に有効な酸触媒であることを見出しました.本反応は,Dean-Stark 装置のような脱水操作が不要で,触媒の分離・除去が容易です.さらに,チオエステル化,エステル交換,マクロラクトン化にも適用できています.
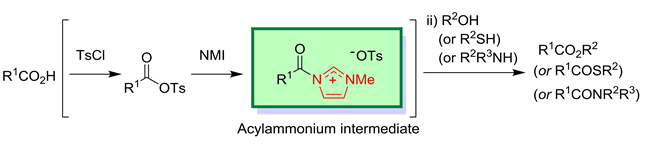
② TsCl – N-methylimidazole 反応剤を用いるエステル化・アミド化・チオエステル化
(Adv. Synth. Catal. 2003, 345, 1209.)
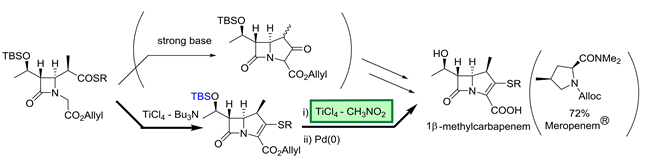
中性縮合剤を用いるエステル化反応は,温和な条件下で行えるため,ファインケミカルズで多用されています.当研究室は,非常に安価なTsCl – N-methylimidazole を用いる total cost-effective な方法を開発しました.種々の官能基を損なうことなく,N-Bocアミノ酸のエステル化においてもラセミ化を全く伴わず,さらに,1β-メチルカルバペネム重要中間体のエステル化・チオエステル化,ピレスロイド殺虫剤プラレスリン®にも適用することが出来ています.
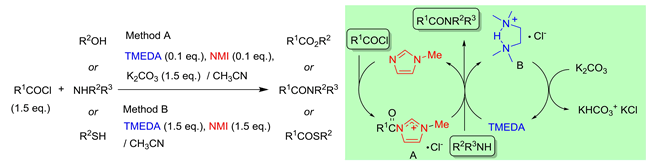
③ 酸クロリドと求核性の劣るアミンのアミド化: N-methylimidazole 触媒 – TMEDA 触媒(シナジー効果) (Tetrahedron 2007, 50, 12071; Adv. Synth. Catal. 2006, 348, 2057.) 酸クロリドとアミンによるアミド化は最も一般的であるが,アミンの求核性が劣る場合,困難を伴う場合があります.N-methylimidazole – TMEDA 触媒を用いる簡便で堅牢な方法を開発しました.調味深いことにアミド化において,触媒量化した Method A の方が明らかに"反応性"が優れています.一般性が高く,除草剤 bromobutide®,carpropamid® の最終鍵段階の合成も従来法より温和で高速に進行しています. また,pH 制御することで,水溶媒中でのエステル化・アミド化にも展開しています.
3.シリル化
アルコールのシリル化は E. J. Corey がプロスタグランジンの合成で利用して以来,有機合成で最も信頼される保護基として確立しています.当研究室では,プロセス化学的観点からシリル化の合理化を検討してきました.
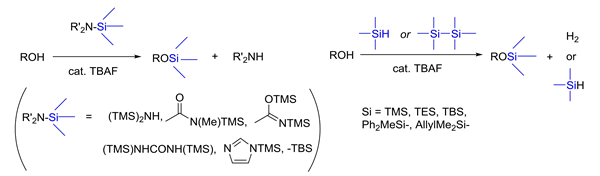
① アルコールの強力シリル化 (A);SiN, SiH, SiSi – cat. TBAF 触媒 (Synthesis, 2005, 2677.)
シラザン(R3Si-N)・ヒドロシラン(R3Si-H)・ジシラン[(R3Si)2] に対し,本来脱シリル化剤として汎用されている TBAF を添加すると,むしろシリル化を強力に促進することを見出しました.複雑な構造を有す Lazalocide 誘導体なども高収率でシリル化できています.
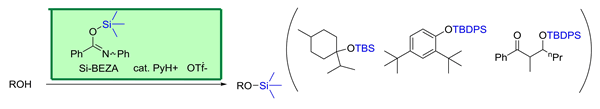
② アルコールの強力シリル化 (B);Si-Benzanilide (Si-BEZA) – cat. PyH+•OTf- (Chem. Commun., 2001, 2478.)
シラザンをシリル化剤とし,PyH+•OTf- 触媒を用いる温和で強力な触媒的シリル化基転移型の反応を見出しました.シラザンの中で O-シリルベンズアミド (Si-BEZA) が特に効果的で,TMS, TES, TBS, TIPS (i-Pr3Si-) および TBDPS (t-BuPh2Si-) 化が可能で一般性が高い方法です.Si-BEZA はベンズアニリドとシリルクロリドから容易に合成でき,比較的安定で長期保存が可能です.
③ 隣接基関与を利用する脱シリル化:TiCl4 – AcOEt or CH3NO2 (J. Org. Chem. 2006, 71, 5380.)
シリル化同様に,脱シリル化する際も艱難を伴うことがあります.TBS エーテルの脱保護として,汎用的で経済的な TiCl4 – ルイス塩基 (AcOEt or CH3NO2) 錯体を用いる方法を見出しました.
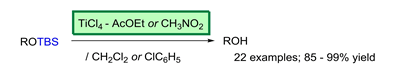
この脱 TBS 化法と脱水型Ti-ディークマン縮合により,ラセミ化することなく,1β-メチルカルバペネム抗生物質の中間体へと導く実用的合成ルートの開発にも成功しています.