
|
| 研究内容 |
| 2007年度 |
2006年度
|
2005年度 |
2004年度 |
組織を構成する機能細胞は(非接着性のものを除いて)生体内で互いに規則的に接着・連絡し合いながら高次の組織構造体の中で巧妙に機能調節しており、再生医療の早期実現のためには細胞が有機的に繋がった組織構造体の構築誘導ならびにその形態制御が必要である。
エピモルフィンは1992年に見出された間質細胞由来の形態形成誘導因子であり、種々の臓器で上皮組織に直接作用し組織構築を促すとともにその形態を制御する。エピモルフィンはシグナルペプチドを持たずC末端に膜結合ドメインを有する一方で、液性因子として強力に上皮の形態形成を誘導するため、その作用機序の解明は組織化メカニズムの新しい概念を確立できる可能性がある。我々の研究室ではこのエピモルフィンを1つのモデル蛋白質として捕らえ、その作用機序を明らかにする試みを継続している。本年度は、エピモルフィンがどのようにして細胞外に効率的に提示・分泌されるか、
また、上皮細胞に存在するエピモルフィンレセプターは何かについての解析を行なった。その結果、エピモルフィンは細胞が損傷を受けた際に効率よく細胞外に提示されること、細胞外に提示されたものは速やかにMMP様のプロテアーゼで膜結合ドメインが切除されること、こうして分泌されたものは上皮細胞上でαV鎖を含むインテグリンに結合することが明らかになった。実際に形態形成という生命現象がアポトーシスによる細胞死を伴う事を考えると、細胞損傷が一連のエピモルフィンの細胞外機能発揮に不可欠か否かは不明であるが、少なくとも1つのcueとして重要なものと想像される。
今後、さらにエピモルフィンについての解析を継続すると共に、これまで内外で蓄積された形態形成に係わる分子群の知見も取り入れ上皮組織の精密な形態制御を試みる。また、研究対象とする細胞を、霊長類の幹細胞ならびにそれを機能分化させて得る正常細胞などに拡張する。 (文責 平井)
第二のテーマとして、皮膚上皮細胞の密着結合の形成過程の解析を行っている。創傷治癒は組織再生の中でも古くから研究がなされている現象である。その過程では傷の周辺の細胞が傷を埋めるべく移動し、さらにこの移動してきた細胞がその新しい周辺環境に応じて分化することが知られている。この細胞移動の過程では、個々の細胞において細胞間、細胞-細胞外基質間の接着が高度に制御されることが重要である。近年、c-Jun N-term Kinase (JNK)
が後者の制御に関与していることが報告された。その一方で、前者の制御機構については未だ不明な点が多い。最近、私はヒト皮膚由来のHaCaT細胞をJNKの阻害剤存在下で培養すると、密着結合の構成因子であるZO-1の局在が変化することを見いだした。この結果は、主要な細胞間接着装置の一つである密着結合の形成過程が、JNKによって制御されている可能性を示唆する。この現象を分子レベルで理解することは、創傷治癒過程での細胞間接着の制御機構の理解につながると考えられる。さらに、本研究で得られた知見は再生医療の分野でも活用されることが期待される。
(文責 青野)
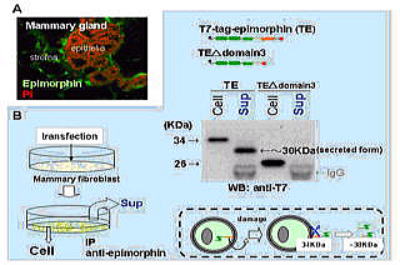 |
A;マウス乳腺(妊娠14日目)におけるエピモルフィンの発現。エピモルフィンの発現は主に間質で認められる(緑)。
B;乳腺間質由来の繊維芽細胞からのエピモルフィンの分泌。タグを付加したエピモルフィン(TE)を細胞に導入すると〜30KDaのC末端が切除されたものが培養液中から検出される。この切断はC末端付近のdomain3配列に特異的であり(TE△domain3を導入した場合には見られない)、可溶性エピモルフィンの分泌はトランスフェクションで細胞が損傷を受けた場合に大量に検出される。
|
|
|
|





