|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
タンパク質の折りたたみ反応径路を探る |
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
タンパク質がランダムコイルの状態から生物機能を持つ構造に正しく折りたたまれることは非常に大切なプロセスです。それが正しく行われないために起きる重大な疾患が最近いくつか分かってきて社会的な問題となっています。タンパク質のポリペプチド鎖がほどけると、とりうる構造の数は天文学的な数になり、一つ一つの構造を巡り歩いて最終の天然構造にたどり着く確率は実質的にはゼロです。したがって、折りたたみ反応には明確な反応径路が存在すると考えられています。その反応径路を決めることが、ゲノム情報からタンパク質機能を知るためにも、タンパク質の構築原理を知るためにも、また折りたたみ反応を制御するためにも大変重要です。タンパク質の折りたたみ問題は、X線結晶解析でタンパク質の立体構造が初めて解明された当初から学問的には興味ある問題として注目されてきましたが、実験的にも、理論的にも解くことが非常に難しい問題として未解明のまま40年近くたっています。 |
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
アンフォールディング反応の分子動力学シミュレーション
リゾチームの折りたたみ反応を計算機実験によって追跡することは現在のところ不可能なので、以下では天然立体構造をほどくことを試みてみました。分子内に存在する一本のS-S結合を欠損させた3SS変異体を異常な高温にして立体構造を壊してみました。もちろんタンパク質は水分子に被われていますが、それは省略して主鎖のリボン模型で表示されています。タンパク質が壊れていく過程のスナップショットですが、実験的証拠はまだ十分ではありません。 |
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
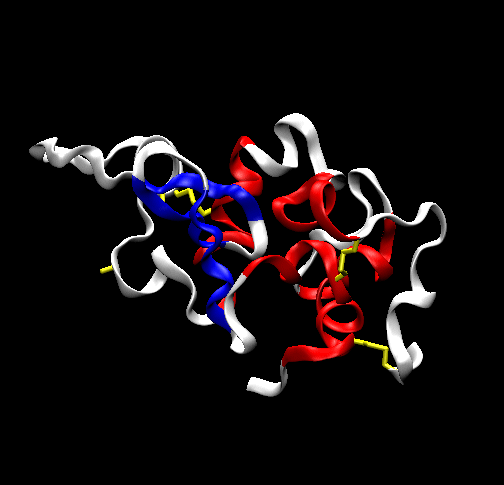
左の図はリゾチームの天然立体構造です。左端の一本のS-S結合(黄色)が切断された3SS変異体です。天然立体構造では赤い4本のへリックスから成るα ドメインと、3本の青いβストランドから成るβドメインが確認できます。 |
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
 |
 |
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
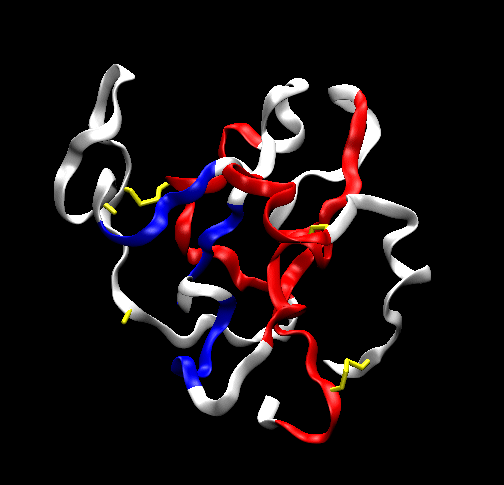
右の図は分子左側のβドメインが壊れ始めたことを示しています。βシートのトポロジーはまだ残っていますが形は崩れています。一方、分子右側のαドメインのへリックスは少し歪んでいるものの天然構造が保存されています。 |
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
左の図では、さらに鎖がほどけてへリックスも消失しています。S-S結合が存在しているため鎖のトポロジーは保存されていますが、鎖の各部分はランダムコイル状になっています。興味あることに、主鎖がターンして折れ曲がる領域が保存されているように見えます。 |
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
ミスフォールディング病 (コンフォメーション病)
たった一つのアミノ酸置換がおきてタンパク質の正しい立体構造が形成できないために起きる遺伝的疾患もありますが、最近はアミノ酸置換が起きなくても物理的な立体構造が間違っているために起きるアミロイド疾患などがよく知られています。プリオン病と呼ばれる神経疾患もプリオンタンパク質のαへリックスがβシートに転換されることによって起きると考えられています。 |
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
 |
|
|
|
|
|
|
|
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |


