|
超伝導磁石NMR分光器 関学のハイテク・リサーチ・プロジェクトで共同利用施設として導入された600MHzのNMR分光器です。左側に見えるのが超伝導磁石、その中心に5mm径のガラス管に入った0.3mLのタンパク質溶液を置きます。タンパク質中の1H、15N、13Cという3つの原子の核磁気共鳴スペクトルを同時に測定できます。右側の箱型のものがNMR分光器です。電波を発生し、ケープルを通して磁石の真中にあるサンプルに照射します。磁石内のサンプルが発生する電波信号を再びケーブルを通して分光器が観測し、その右隣のコンピュータがデータを解析します。 |
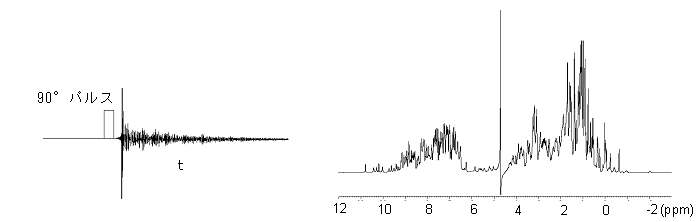
へのフーリエ変換
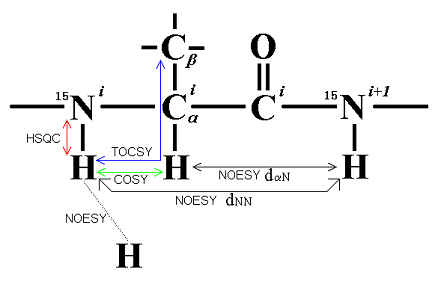
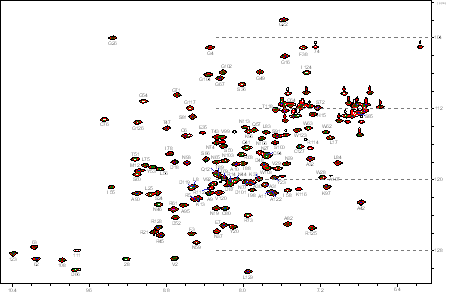
タンパク質の構造を解析するためには、タンパク質のポリペプチド主鎖に沿うH、N、Cαの共鳴周波数を測定する必要があります。原子の数が非常に多いため、1次元NMRスペクトルでは1Hのピークだけでも重なり合って、それぞれのピークを区別することができません。そのため特別なパルス列からなる電磁波を、1Hと15Nあるいは13Cに同時に照射して、連結した15Nと1H(あるいは13Cと1H)の核の共鳴周波数を2次元平面上の交点の座標として同時に決定することができます。これを2次元NMRスペクトルといいます(下図参照)。最近ではさらに、3核を同時に照射して3次元の周波数空間上にスペクトルを描く多次元NMR法が用いられています。