NMRスペクトルの測定原理
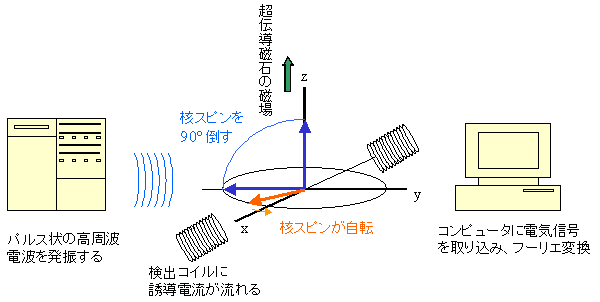
パルス・フーリエ変換NMR分光器の測定原理を簡単に図示します。下の図に示されたように箱型の分光器において、高周波(600MHz)の電波(ラジオ波)をパルス状(パルス時間幅約10μs)に整形して発生させ、ケーブルを通して超伝導磁石の中央にセットされたタンパク質の入ったサンプル管に照射します。サンプル中のプロトンは超伝導磁石の静止磁場(z軸)を中心として歳差運動していますが、照射したラジオ波の周波数と、歳差運動の周波数(ラーマ周波数)がちょうど一致する(共鳴)とプロトンの核スピンは90°倒れます。xy平面上に倒れた核スピンの運動は検出コイルに誘導電流を発生し、FID信号(Free Induction Decay)として観測されます。
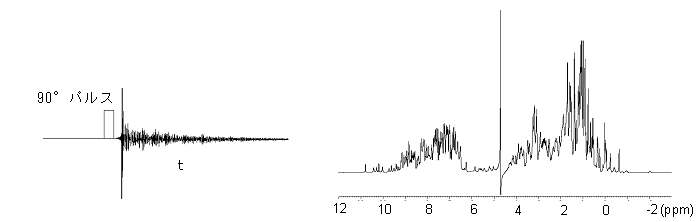
FID信号
NMRスペクトル
時間軸から周波数軸へのフーリエ変換
タンパク質中には非常に沢山のプロトンが存在します。100残基程度のタンパク質でも約700個のプロトンのラーマ周波数を識別する必要があります。1次元のNMRスペクトルでは込み合ってとても識別できません。そこで非常に巧妙な方法を考案したのがR.R.Ernst(1991年ノーベル賞)という人です。第1のパルスで隣接プロトンを90°倒し、第2の90°パルスを照射するまでの待ち時間(展開時間 t1)を色々の長さにとって観測プロトンのFID信号を観測すると、FID信号に隣接プロトンのラーマ周波数とt1時間に依存した振幅変調がかかる結果になるのです(右図参照)。このように、展開時間t1 に応じてFID信号が変化するのは電子スピン結合で相互作用する隣接プロトン間にコヒーレンス移行と呼ばれる現象が起きるからですが、その説明は行列形式の量子力学を必要とするのでここでは省略します。
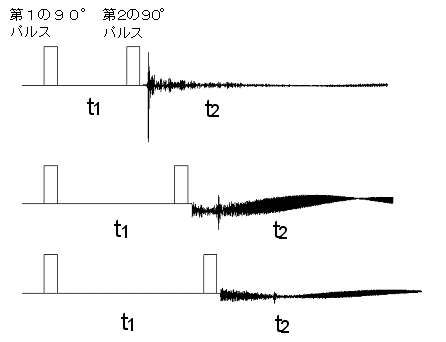

図をクリックすると拡大します。