タンパク質の折りたたみ問題とは
ゲノム上の遺伝暗号にしたがってタンパク質の合成が始まり、アミノ酸が100〜300個程度連結されたポリペプチド鎖が細胞内に発現します。このときタンパク質はまだ無定形の鎖状高分子ですが、アミノ酸残基と溶媒の水分子間の物理化学的相互作用によって、きわめて正確に一定の秩序(立体)構造に折りたたまれ、アミノ酸配列に固有の生物機能を獲得します。100残基からなるタンパク質でも、折りたたまれた時にとりうる立体構造の数は1060という莫大な数になりますが、そのうちただ一つの立体構造しか選択されないのはなぜでしょう。よほど強い決定的力が働いているようにみえますが決してそうではありません。むしろファン・デル・ワールス力や水素結合という弱い力が多くの構成要素間に働いてたった一つの立体構造を選択的に決定しています。アミノ酸配列のみがタンパク質の立体構造(生物機能)を決定する要因です。すなわち、非周期的なアミノ酸配列という情報が物理化学的な基本原理に従う「ブラックボックス」を通してタンパク質の生物機能という個性を決めているということになります。この問題を解くことがタンパク質の折りたたみ問題と呼ばれています。
物理化学的
基本原理
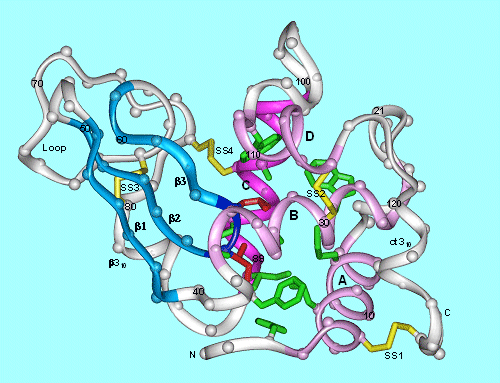
左図のような紐状のポリペプチド鎖は自発的に折りたたまってコンパクトな球状の立体構造を形成します。主鎖の折りたたみ構造を見るためにはCα原子を滑らかにトレースしたリボン図で表示するとよく分かります。右側のドメインに4本のαへリックス(紫色)が折りたたまれ、左側のドメインはベータ鎖と呼ばれる伸長ペプチド鎖(青色)が3本反平行に並んだ構造をしています。両側のドメイン間には深い溝があってこの部分にバクテリアの細胞壁を結合してそれを加水分解(溶菌)する機能をもっています。
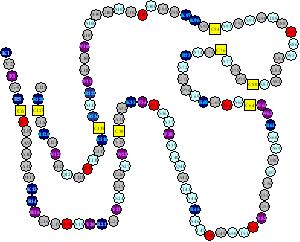
リゾチームのアミノ酸配列(1次構造)。N末端(残基番号1)のK1(リジン)からC末端のL129(ロイシン)まで129残基から構成されています。途中黄色で示した残基C(システイン)は一本鎖の途中で共有結合(S-S結合)による架橋を形成しています。我々は遺伝子操作をして特定部位のS-S結合を欠損させた変異体タンパク質を作製して折りたたみ反応中間体のモデルとして研究しています。