水中の光合成と珪藻類について(About aquatic photosynthesis and diatoms)
水に溶ける二酸化炭素(CO2)濃度は、大気のCO2分圧に比例しており、現在の大気組成では20℃でせいぜい15 μM程度しか溶けません。この濃度は水中で光合成行うほとんどの生物が持つCO2固定化酵素ルビスコに必要な濃度よりもかなり低いため、水中光合成のシステムは何らかの戦略を使ってこの問題を克服しなければなりません。海洋などの水中で光合成を行う生物は、陸上植物とは進化的に独立したものも多く、独自の戦略で光合成を行っています。
葉緑体の祖先はシアノバクテリアですが、珪藻は二次共生生物と言って、シアノバクテリアを葉緑体化した一次共生藻類を、別の宿主がさらに取り込んで葉緑体化した生物です。1997年に行われたリモートセンシング衛星による海洋光合成量の推計から、海洋でのCO2固定は地球全体の少なくとも50%(それ以前の推計値は16%程度)で、珪藻がこのうち40%程度(つまり地球全体の20%程度)を占めていることがわかりました。我々が5回呼吸をするとそのうちの1回は珪藻が作り出した酸素を吸っているわけです。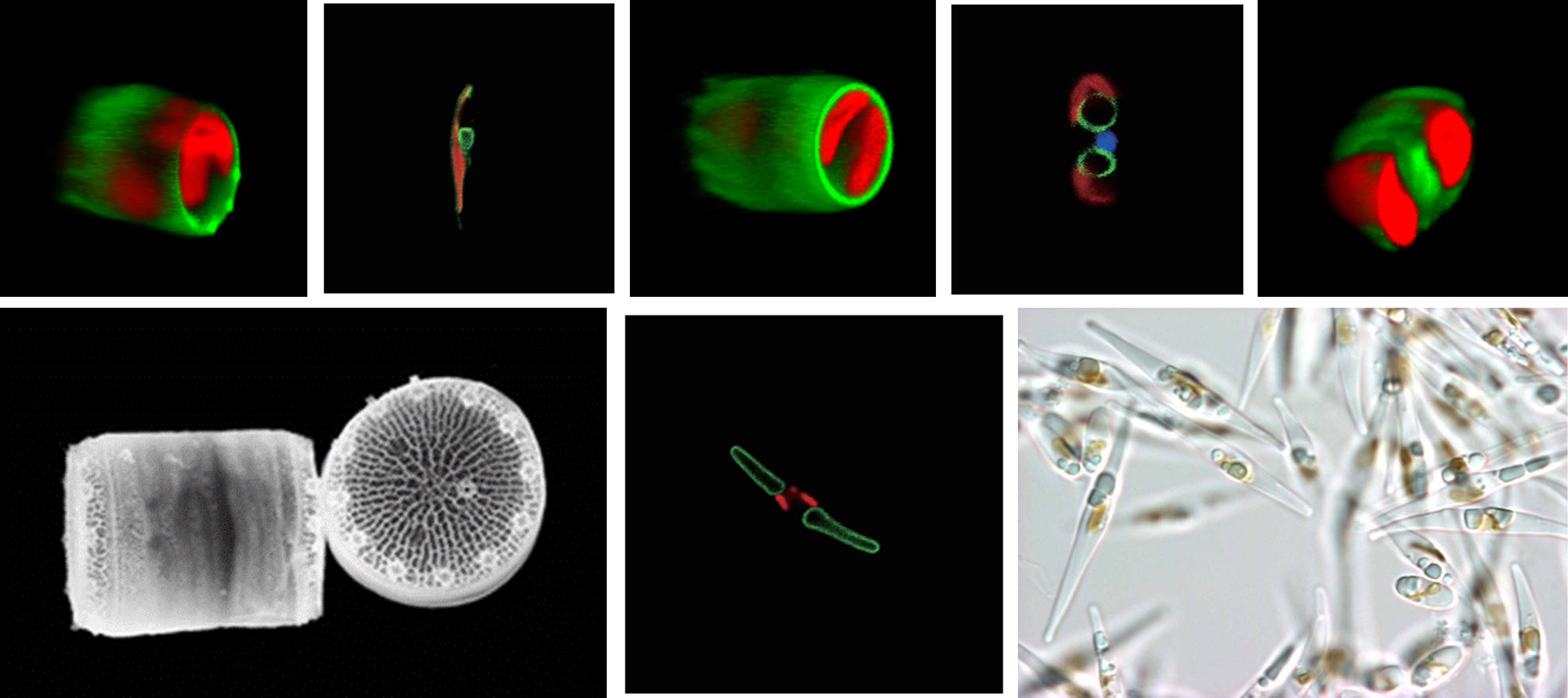
この発見を機に海洋性の珪藻に注目が集まりました。しかし彼らの葉緑体構造は特殊です。四重包膜であり、葉緑体内にはグラナススタック構造もなく、三重に重なったチラコイド膜ユニットが幾重にもなって、中心部のピレノイドというタンパク質ボディを囲んでいる構造をしています。また、細胞壁はセルロースではなくアモルファスシリカ(つまりガラスですね)でできており、陸上職物や緑藻などとは似ても似つかない細胞です。
2000年代に入ると珪藻のゲノムが相次いで解読され公開されましたが、機能が全く不明な遺伝子が45%も含まれ、代謝系も教科書的なものから大きく逸脱していることが徐々に分かってきました。そしてこのような二次共生によって葉緑体を獲得した光合成生物は、真核生物のほとんどのグループに存在していることも分かってきています。つまり珪藻の研究は、地球全体の一次生産(光合成)だけでなく、真核生物の多様な細胞機能の進化に多くのヒントや答えをもたらす新しい研究分野といえるでしょう。現在、遺伝子導入はもとより、RNA干渉やゲノム編集など、多くの分子ツールの使用も可能となっており、我々の研究室ではこれらをさらに充実させながら駆使して、珪藻と海洋光合成の謎を解明しています。
海洋性珪藻のCO2濃縮機構(CO2-concentrating mechanism: CCM in marine diatoms)
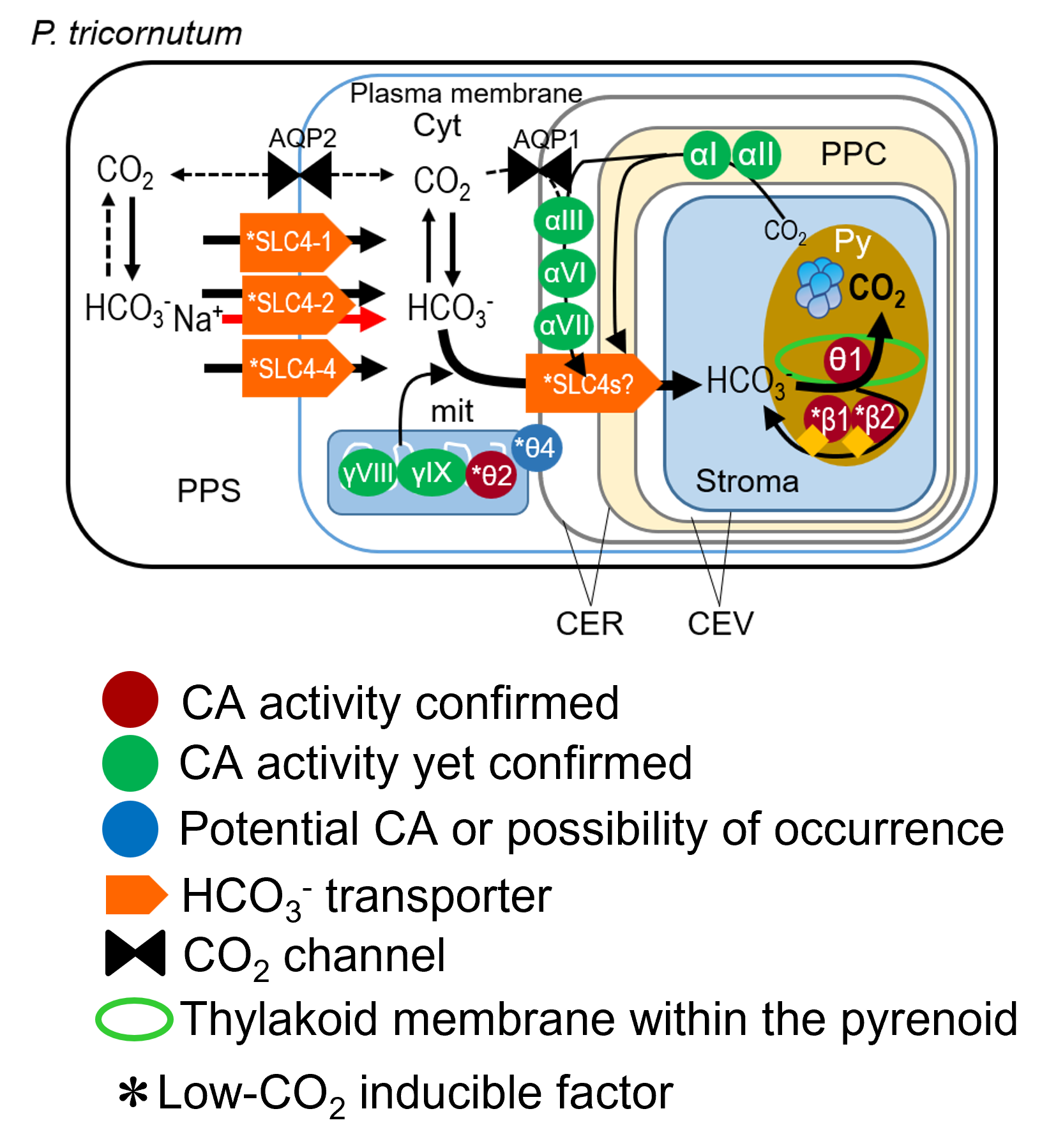
水に溶けるCO2は少ない一方で、溶けたCO2は水と結合してイオンになります(重炭酸イオン:HCO3-)。HCO3-はpHや塩濃度が高いほど迅速に生成され且つ逆反応は遅くなるため、特に海水のような高塩度アルカリ環境では安定に2 mM 程度が保持され、溶存無機炭素の大きな貯留形態となっています。そのためHCO3-を光合成の基質として使うことが出来れば、上にあげた何らかの戦略として有効に働くでしょう。
海洋性珪藻類では、ヒトの各臓器細胞などでも働いているSolute Carrier (SLC) 4型の細胞膜輸送体を、CO2濃度が低いときに高発現し、これをポンプのように働かせて海水に豊富に存在するHCO3-を直接細胞内に取り込む分子機構を我々が発見し、2013年に発表しました。
取り込まれたHCO
そこで珪藻細胞は葉緑体のCO2固定場所の直前までHCO3-を持って行き、ルビスコが集合している場所でのみCO2を発生するという戦略をとっています。このルビスコが集まった場所をピレノイドと呼び、ここでCO2を発生するために、光のエネルギーで作り出されたpH濃度勾配を利用して、チラコイド膜内腔の酸性環境でHCO3-からのCO2発生を行います。これにはこの反応を特異的に触媒する酵素が必要です。この酵素を炭酸脱水酵素(carbonic anhydrase: CA)と呼びます。珪藻チラコイド内腔で働く全く新しいアミノ酸配列のCAを我々は発見・同定し、これをθ型CAと名付けて2016年に発表しました。θCAはその後多くの水中光合成生物に存在することも分かってきました。
CAはこれだけではなく、葉緑体ストロマや葉緑体包膜にも存在し、漏れ出そうとするCO2を再びHCO3-に変えて葉緑体内に無機炭素として留める働きを担っていると考えています。また、細胞質や細胞外にも別のタイプのCAが存在し、これらはそれぞれ、細胞と葉緑体が無機炭素を獲得するのを助けています。我々は珪藻におけるCAの多くを局在決定し、その機能の確認も行っています。
これまでの研究から、HCO3-を取り込んで葉緑体まで届ける仕組みは生物種によってかなり多様であることが分かってきました。一方で、葉緑体内の限られた場所でのみHCO3-からCO2を発生する「水中葉緑体」の仕組みは生物種を超えて共通の設計理念に基づいていることが分かってきました。ここに関わるピレノイドの構造と光化学系との役割連携は水中光合成の鍵であり、現在我々の重要研究課題の一つとなっています。
ピレノイドはこれまで、単なるルビスコの集積体であると考えられてきました。しかし、ここがチラコイド膜と接して液晶構造をとる理由は解っていません。光とCO2供給のバランスをとるための構造と機能は、葉緑体機能最適化の最重要課題であり、ピレノイドの構造と機能の解明が一つの重要な答えを導くと考えています。
海洋性珪藻のCO2センシング(CO2 sensing in marine diatoms)
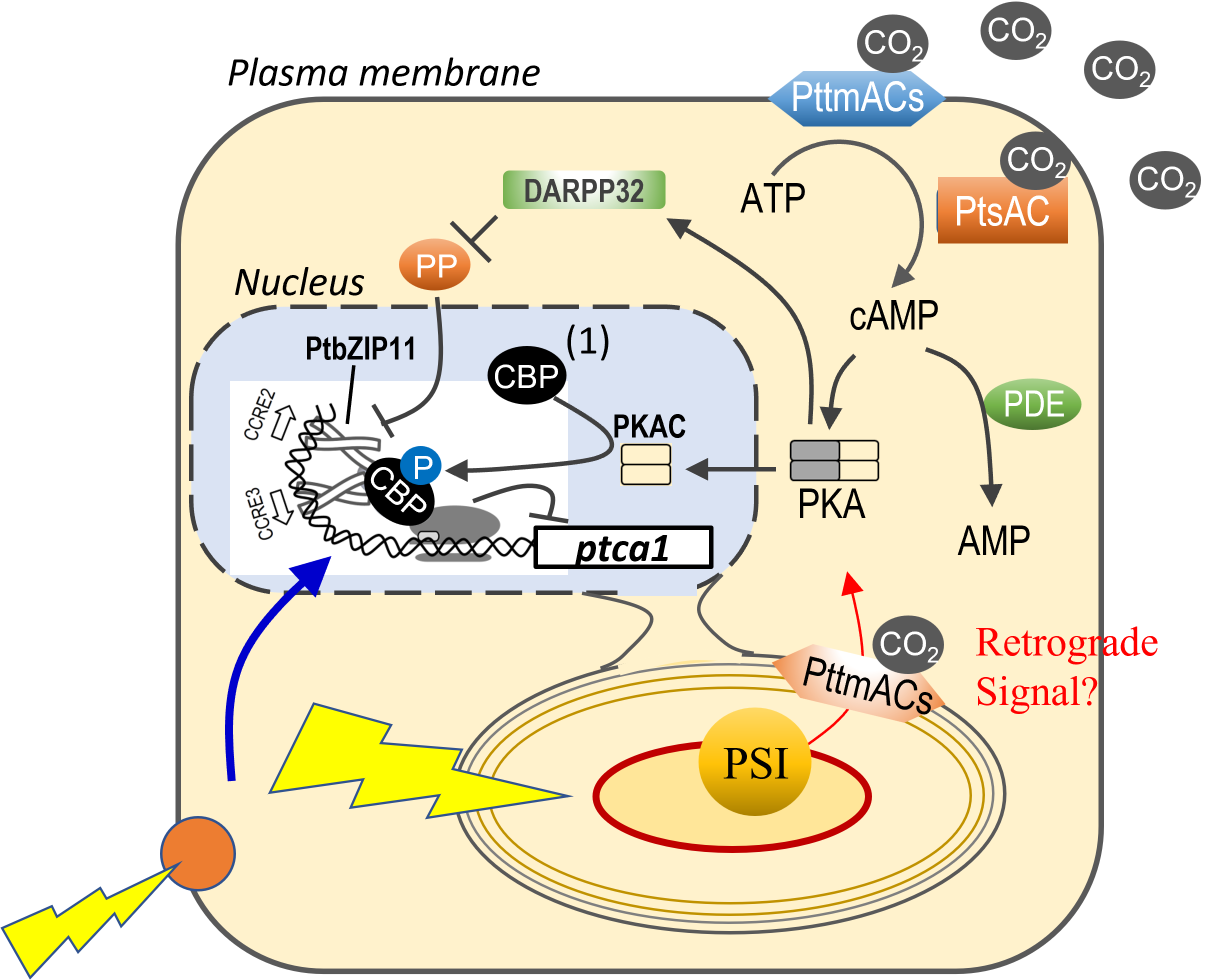
私は学生のころから生物が環境因子をシグナルとして感知して組織や細胞の体制を新しい環境に順化させる仕組みに興味を持っていました。博士課程学生の時は陸上植物が北海道のような寒冷地で凍てつく温度に迅速に順化して、長い冬を乗り越える仕組みを研究していましたが、時代はCO2と温暖化が取りざたされ始めた1990年代前半、学位取得を機に、やや大きめに分野を変えCO2をセンシングする仕組みの研究に舵を切りました。これが、カナダでのポスドク時代のテーマだった緑藻クロレラのCO2センシング機構との出会いです。
Toronto の York 大学で Brian Colman 教授のもと4年間取り組んだことが光合成研究と現在の研究テーマへの入り口となりました。York大の研究室ではウェールズ出身の女子学生が海洋性珪藻類を相手に四苦八苦の奮闘をしていました。彼女の純生ウェールズ英語といつもディディスカッションし、海洋性珪藻の挙動がとても淡水生のものと違っていたことから、「この海の生物は一筋縄じゃなくて、ずいぶん面白い。」と感じ始め、帰国する時には、ボスに頼んでこの株を持ち帰りました。
運よく採用された関学(当時は化学科)で、細々と珪藻の光合成特性とCO2応答の研究をスタートしました。それが上にも書いている珪藻光合成の再評価と時期が一致していたわけです。分野のインパクトや分子ツールの充実そして生命科学科の発足と歩調を合わせ、珪藻の研究がどんどん進むようになりました。
海洋性珪藻のCO2センシングにはサイクリックAMP(cAMP)が関わっていることを最初の博士課程学生である原田君(現 鳥取大)が見出し、これを2005年と2006年に発表しました。その後、このシグナルを受け取るプロモーター配列にはCO2-cAMP responsive element(CCRE)があり、CCREには PtbZIP11 というbZIP型転写因子が結合すること、そして光のシグナルもこのシステムが受容していることを、新たに発足した生命科学科の初期の学生・院生たちが突き止め、2012年と2016年に発表しました。現在、このさらに上流のCO2シグナル伝達系を調べています。
様々なタンパク質発現系と応用研究(Protein synthesis systems and applied research)
研究を日々行っていると、新しい分子や機能や現象の発見だけでなく、新しい技術の開発もまた研究を新たなフェーズに押し上げてくれる局面に割と頻繁に遭遇します。PCR技術然り、ゲノム編集技術然りです。これらはツールというだけでなく、その中には深遠な生物学や生化学そして物理化学を内包している大変面白い研究対象です。研究が軌道に乗ってからの新しい試みとして、我々はツール開発にも遊び心をもって積極的に取り組んでいます。
タンパク質の発現場所を知るための技術は、任意のタンパク質を狙ったところに発現させる技術としても使えます。珪藻類にはガラスでできた比表面積の巨大な多孔質細胞壁(frustuleといいます)がありますが、この部位に提示発現されるタンパク質やペプチドも知られています。この細胞壁は silica-deposition vesicle (SDV) という特殊な分泌小胞の働きで珪藻の中で作られ細胞分裂面に配置されます。SDVにタンパク質を送り込むシグナル配列は判明しており、これを使えば任意の有用タンパク質を珪藻に発現させ、細胞表面に提示させることが可能です。このようにして提示発現したタンパク質はそのまま固定化酵素となり、機能材料として使うことが可能です。
また、タンパク質を単純に高発現させたり細胞外に排出させたりするための昆虫細胞、麹菌などのシステム活用にも企業と協力して取り組んでいます。
一方、海洋性珪藻の光合成特性を精査する技術とノウハウを珪藻による油脂生産の最適化につなげるアルゴリズム開発、あるいはストラメノパイルに属する微細藻である珪藻で培った分子ツール技術を、同じストラメノパイルに属する大型藻にも応用してブルーカーボンを生産・活用する技術開発にも取り組んでいます。
